Yrd. Doç. Dr. Atilla EVCİN Afyonkarahisar Kocatepe Üniversitesi Fe 2+ oluşumunun hızı =
|
|
|
- Melek Şipal
- 7 yıl önce
- İzleme sayısı:
Transkript
1 KİMYASAL KİNETİK Kimyasal kinetik, bir reaksiyonunun nasıl yürüdüğü, ne kadar hızlı yürüdüğü, hangi mekanizma ile (yoldan) yürüdüğü ve hızına hangi faktörlerin nasıl etki ettiği hakkında bilgi veren, kimyanın çalışma alanlarından biridir. MÜHENDİSLİK KİMYASI DERS NOTLARI Yrd. Doç. Dr. Atilla EVCİN Bir başka ifade ile kimyasal kinetik, bir reaksiyonun başladığı andan dengeye ulaşana kadar geçen süredeki yürüşüne ilişkin zamana bağlı olarak değişen nicelikleri belirlemeye çalışır. Bu nedenle kimyasal kinetik denklemlerinde her zaman bir zaman (t) terimi yer alır. Dengeye ulaşmış bir reaksiyonda artık "kinetik süreç" bitmiştir ve denge olayları termodinamik tarafından incelenir. Kimyasal Reaksiyonların Hızı Reaksiyon hızı, "birim zamanda bir reaktant veya bir ürünün derişimindeki değişim olarak tanımlanır. Reaksiyon hızının birimi çoğu zaman mol/ lt zaman olarak verilir ve zaman birimi için reaksiyon hızına bağlı olarak saniye, dakika, saat, gün vs gibi bir birim seçilir. Reaksiyonların çoğunun hızı, başlangıç anından dengeye ulaşılıncaya kadar sabit olmayıp sürekli olarak düzgün bir şekilde değişir. Zamanla derişimin değişiminin hızı. Fe 3+ (aq) + Sn + Fe + (aq) + Sn 4+ (aq) t = 38.5 s [Fe + ] = M = 38.5 s [Fe + ] = ( ) M Fe + oluşumunun hızı = [Fe + ] = M 38.5 s = M s -1 1
2 Genel denklem için Fe 3+ (aq) + Sn + Fe + (aq) + Sn 4+ (aq) [Sn 4+ ] = 1 [Fe + ] = - 1 [Fe 3+ ] a A + b B c C + d D Reaksiyon hızı = reaktanların derişimlerinin zamanla azalması = - 1 a [A] = - 1 b [B] = ürünlerin zamanla oluşum hızı = 1 c [C] = 1 d [D] Reaksiyon Hızının Ölçülmesi H O (aq) H O(l) + ½ O (g) H O (aq) H O(l) + ½ O (g) -(-.3 M / 1360 s) = 1.7 x 10-3 M s -1 Hız = - [H O ] 1 MnO 4- (aq) + 5 H O (aq) + 6 H + Mn + +8 H O(l) + 5 O (g) -(-1.7 M / 600 s) = 6 x 10-4 M s -1 1
3 100 s sonra derişimi nedir? [H O ] i =.3 M Hız = 1.7x 10-3 M s -1 = - [H O ] - [H O ] = -([H O ] s -[H O ] i ) = 1.7 x10-3 M s -1 x [H O ] 100 s.3 M = -1.7 x 10-3 M s -1 x 100 s =.3 M M [H O ] 100 s =.17 M Hız Kanunu : Derişimin etkisi a A + b B. g G + h H. Reaksiyon hızı = k [A] m [B] n. Hız sabiti = k Reaksiyon derecesi = m + n +. Çok basamaklı bir reaksiyonun denkleştirilmiş reaksiyon denklemine bakarak reaksiyon hızı ifadesi yazılamaz. Ancak bir kimyasal reaksiyonun, basit (elementer) reaksiyon olduğu biliniyorsa, reaksiyon denklemine bakılarak hız ifadesi yazılabilir. Daha önce verdiğimiz NO ile H arasındaki örnek reaksiyonunun denkleştirilmiş reaksiyon denklemi şeklindedir. İki adımda yürüdüğü bilinen bu reaksiyona ilişkin hız denklemini, reaksiyona bakarak yazmak mümkün değildir. Şimdi bu reaksiyonun deneysel olarak belirlenen iki adımını yani mekanizmasını yazalım. Bu iki basit reaksiyondan birincisi yavaş, ikincisi hızlı yürüyen bir reaksiyondur ve bu durumda reaksiyonun hızını belirleyen basit reaksiyon birinci basamaktır. O halde reaksiyon hızı birinci reaksiyondaki derişimler ile orantılı olacaktır. 3
4 Basit Reaksiyonlar Reaksiyonun stokiyometrik katsayıları ile reaksiyon hız denklemindeki üstel sayıların aynı olmadığı burada açıkça görülmektedir. HgCl ve C O 4 arasındaki reaksiyon için aşağıdaki veriler elde edilmiştir. Reaksiyon hızını, derecesini bulunuz. Yukarıda verilen basit bir reaksiyon için hız denklemini yazınız. Reaksiyon basit yani tek adımda yürüyen bir reaksiyon olduğu için, reaksiyon denklemine bakılarak hız denklemi yukarıdaki şekilde yazılabilir. 4
5 R 3 = k.[hgcl ] 3m.[C O 4 ] 3 n R = k[hgcl ] 1 [C O 4 ] n = k(0.105)(0.30) n R 1 = k[hgcl ] 11 [C O 4 ] 1n = k(0.105)(0.15) n R = k. [HgCl ] m. [C O 4 ] n = k.([hgcl ] 3 ) m.[c O 4 ] n 3 R R ] 3 n k.([hgcl ] 3 ) m.[c O = 4 R 3 k.[hgcl ] 3m.[C O 4 ] n 3 K. m.[hgcl ] m 3.[C O 4 ] n = 3 = m R 3 =.0 R 3 k.[hgcl ] 3m.[C O 4 ] n 3 m =.0 buradan m = 1.0 R 3 R R 1 R R 1 = k(0.105)(0.30) n k(0.105)(0.15) n (0.30) n = = n = (0.15) n = 3.94 n = 3.98 buradan n =.0 Sıfırıncı Derece Reaksiyonlar Sadece katalizör varlığında gerçekleşen reaksiyonlardır A ürünler R rxn = k [A] 0 1 R = k[hgcl ] [C O 4 ] Birinci derece + İkinci derece = Üçüncü derece R rxn = k [k] = mol L -1 s -1 5
6 Sıfırıncı Derece Reaksiyonlar Birinci Derece Reaksiyonlar - [A] -d[a] = k = k dt 0 dan t anına integrali alındığında [A] t - d[a] = kdt [A] 0 0 -[A] t + [A] 0 = kt [A] t = [A] 0 -kt t d[h O ] dt H O (aq) H O(l) + ½ O (g) = -k [H O ] [A] t [A] 0 d[h O ] [H O ] = - k dt ln [A] t = -kt ln[a] t = -kt + ln[a] 0 [A] 0 0 t [k] = s -1 Birinci Derece Reaksiyonlar Yarılanma Süresi (Ömrü) t ½, yarılanma süresi, reaktanın başlangıç derişiminin yarıya düşmesi için geçen süredir. ln [A] t [A] 0 = -kt ln ½[A] 0 = -kt [A] ½ 0 -ln = -kt ½ t ½ = ln k = k 6
7 Bazı Tipik Birinci Derece Reaksiyonlar İkinci Derece Reaksiyonlar A ürünler A ürünler A + B ürünler d[a] dt = -k[a] [A] t [A] 0 d[a] [A] [k] = M -1 s -1 = L mol -1 s -1 = - kdt 0 t 1 1 = kt + [A] t [A] 0 Reaksiyon Hızını Etkileyen Faktörler SICAKLIK Bir reaksiyonun daha yüksek sıcaklıkta yürütülmesi ortamdaki yüksek enerjili moleküllerin sayısını veya kesrini arttıracağından sonuçta reaksiyon hızı artar. Reaksiyon hız sabiti ile sıcaklık arasındaki ilişki Arrhenius tarafından bulunmuş ve bu ilişkiyi veren denklem "Arrhenius denklemi" olarak bilinir. Arrhenius denklemi aşağıdaki ifade ile verilebilir. - Burada k ; reaksiyon hız sabiti, E a ; Aktivasyon (etkinleştirme) enerjisi, A ; bir sabittir. İki farklı sıcaklıktaki hız sabitleri için bu denklem 7
8 Bir reaksiyonun 98 K' daki reaksiyon hız sabiti 3,0 x 10 - s -1 olarak belirlenmiştir. Bu reaksiyonun etkinleşme enerjisinin 15 kj mol-1 olduğu bilindiğine göre reaksiyonun 35 K 'daki hız sabitini hesaplayınız. (R = 8,314 JK-1mol-1 ). Katalizörlerin görevleri KATALİZÖR Endüstriyel açıdan önemli olan bazı kimyasal reaksiyonların hızı ekonomik bir üretim için yeteri kadar yüksek olmayabilir. Bu nedenle bu tür reaksiyonlarda "katalizör olarak adlandırılan maddeler kullanılarak, reaksiyonların (ortamda katalizör bulunmadığı duruma göre) çok daha kısa sürede dengeye ulaşması sağlanır. Katalizörlerin görevleri ve özelliklerine ilişkin şu genellemeler yapılabilir: Bir reaksiyonda katalizör kullanımı, reaksiyonun katalizlenmesidir. Katalizör, ortama reaktantlara göre çok az miktarda konulur ve reaksiyon sırasında tüketilmediğinden reaksiyon sonunda aynen açığa çıkar. 8
9 Katalizörlerin görevleri Katalizör reaksiyonun denge konumunu değiştirmez ve reaksiyonu sadece katalizlenmemiş reaksiyon için gerekli olan Ea 'den daha düşük bir Ea 'ne sahip bir yoldan yürütür Katalizör yürümeyen bir reaksiyonu yürür hale getiremez. Katalizörler genel olarak her reaksiyon için özeldirler. Bir reaksiyon için reaksiyonu çok iyi katalizleyen bir katalizör, benzer reaktantları içeren bir başka reaksiyon için iyi bir katalizör olmayabilir. Katalizörler genelde homojen ve heterojen katalizörler olarak ikiye ayrılırlar.homojen katalizörler, reaktant ve ürünler ile aynı fazdadır. Heterojen katalizörler ise, reaktant ve ürünlerden farklı fazda bulunurlar ve genellikle katıdırlar. Heterojen Reaksiyonlarda Temas Yüzeyi Homojen kimyasal reaksiyonlarda, reaksiyonlar aynı fazda bulunan reaktantlar arasında yürüdüğünden, reaktant molekülleri her an birbiriyle çarpışabilmektedir. Ayrı fazlarda, özellikle katı-sıvı ve katı-gaz fazlarında reaktantları bulunan heterojen reaksiyonlarda ise, reaksiyon hızı bu reaktantların birbirleriyle olan etkileşme sayısına veya sıklığına bağlıdır ve bu sayı etkileşmenin gerçekleştiği temas yüzeyi ile doğru orantılı olarak değişmektedir. Örneğin demir metali H SO 4 çözeltisi içine atılırsa Fe (k) + H SO 4 (sulu) H (g) + FeSO 4 (sulu) reaksiyonu gereği H gazı ve FeSO 4 (sulu) oluşur. Burada reaksiyonun hızı demirin yüzeyinin büyüklüğüne bağlı olacaktır. Eğer demir metali öğütülüp ortama konursa reaksiyon için elde edilen temas alanı, demiri tek bir parça olarak ortama koyduğumuzda elde edilen temas alanından daha büyük olur. N O 5(s) 4NO (g) + O (g) Reaksiyonu için hız denklemlerini yazınız. 9
10 Reaksiyonun hızını bulunuz yazınız. H 3 O + için 85 ile 95 saniye arasında ( T=10s) molarite değişimi mol/l Karşılaştırma yöntemiyle reaksiyon hızını bulunuz. Hız = k [reaktan] n Hız = k [HI] KİMYASAL DENGE Kimyasal Denge Birbiriyle reaksiyona girebilen maddeler biraraya getirildiğinde ve gerekli koşullar sağlandığında ürün veya ürünler oluşmaya ve reaktant veya reaktantların miktarı azalmaya başlar. N O 4 (g) NO (g) equilibrium equilibrium equilibrium İlk anda yüksek olan ürün oluşum hızı (rh i ), reaktantların miktarları ürün oluşturmaları nedeniyle azaldığından, zamanla düşer. Öte yandan bir süre sonra, reaksiyonun tersi de (rh g ) artan bir hızla gerçekleşmeye başlar. Sonuçta, bu birbirine göre ters yönde ilerleyen iki reaksiyonun hızları eşit hale gelince kimyasal denge kurulmuş olur. NO ile başladığında N O 4 ile başladığında NO & N O 4 ile başladığında 10
11 Kinetik ve Dengenin Birleşmesi Dengenin Özellikleri k i N O 4 NO k g Denge hız i = hız g k i [N O 4 ] = k g [NO ] k i hız i = k i [N O 4 ] hız g = k g [NO ] [NO ] = K k D = g [N O 4 ] Fiziksel Denge H O (l) H O (g) Kimyasal Denge N O 4 (g) NO (g) Ürünlerin reaktanlara oranıdır. Her bir bileşen denkleşmiş reaksiyondaki sabit kadar üstel kuvvete sahiptir. a A + b B c C + d D Çift yönlü ok dengeyi gösterir. K = [C]c [D] d [A] a [B] b K >> 1 Ürünler lehine K << 1 Reaktanlar lehine Homojen denge tüm reakisyona giren ve oluşan ürünlerin hepsinin aynı fazda olduğu reaksiyonlardır. N O 4 (g) K D = [NO ] [N O 4 ] Homojen Denge CH 3 COOH (aq) + H O (l) NO (g) K p = P NO P N O 4 Çoğu durumlarda K D K p CH 3 COO - (aq) + H 3 O + (aq) [CH K D = 3 COO - ][H 3 O + ] [CH 3 COOH][H O] [H O] = sabit K D = [CH 3 COO- ][H 3 O + ] [CH 3 COOH] = K D [H O] 11
12 Heterojen Denge CaCO 3 (s) CaO (s) + CO (g) Heterojen denge reaktan ve ürünlerin farklı fazlarda olduğu reaksiyonlardır. Genellikle sıvı ve katı fazda olurlar. CaCO 3 (s) CaO (s) + CO (g) K c = [CaO][CO ] [CaCO 3 ] K c = [CO ] = K c x [CaCO 3 ] [CaO] [CaCO 3 ] = constant [CaO] = constant K p = P CO P CO = K p P CO CaCO 3 ya da CaO miktarına bağlı değildir N O 4 (g) NO (g) NO (g) N O 4 (g) NO (g) N O 4 (g) NO (g) ½N O 4 (g) K c = [NO ] [N O 4 ] = 4.63 x 10-3 K = [N O 4 c ] = 1 = 16 [NO ] K c K = [N O 4 ] c [NO ] = 16 K = [N O 4 c ]1/ = 14.7 [NO ] 1
13 Denge Bağıntısının Yazılması SO 3 (g) SO (g)+o (g) C (k) + Cl (g) CCl 4 (g) Denge bağıntısında katı gösterilmez CO (g) + H (g) CO(g) + H O(s) Denge bağıntısında sıvı gösterilmez K = [SO ] [O ] [SO 3 ] K = [CCl 4 ] [Cl ] [CO] K = [CO ][H ] 95 K de aşağıdaki reaksiyonu düşünelim: NH 4 HS (s) NH 3 (g) + H S (g) Her bir gazın kısmi basıncı 0.65 atm olduğuna göre K p yi hesaplayınız. K p kısmi basınçlar cinsinden ifade edilen denge sabitidir. K p = P NH3 P H S = 0.65 x 0.65 = Aşağıdaki reaksiyon için 74 0 C de denge derişimleri sırasıyla [CO] = 0.01 M, [Cl ] = M ve [COCl ] = 0.14 M. Buna göre denge sabiti K c yi hesaplayınız. K c derişimler molarite cinsinden verildiğindeki denge sabitidir. CO (g) + Cl (g) K c = [COCl ] [CO][Cl ] = COCl (g) x =. x 10 Denge sabiti K p aşağıdaki reaksiyon için 1000 K de 158 dir. NO (g) NO (g) + O (g) P NO = atm ve P NO = 0.70 atm olduğuna göre Oksijenin denge basıncı ne olur? K p = P NO P O P NO P P NO O = K p P NO P O = 158 x (0.400) /(0.70) = 347 atm 13
14 Denge sabiti K c 800 K de aşağıdaki reaksiyon için dır. HI (g) H (g) + I (g) Eğer [HI] = 0.10 M ve [H ]= [I ]ise H nun denge derişimini bulunuz. K c = [H ][I ] [HI] K c [HI] = [H ] [H (0.016 x 0.10 x 0.10) 1/ ] = [H ] = 0.013M Le Chatelier s Prensibi Dengeye ulaşmış bir kimyasal reaksiyon, denge koşulları değiştirilmediği sürece dengede kalır. Bir başka ifade ile kurulmuş bir dengenin, sıcaklık, derişim ve basıncı değiştirilmedikçe denge konumu korunur. Ancak bu faktörlerden biri veya birkaçı değiştirildiğinde reaksiyonun denge konumu bozulur ve reaksiyon yeni koşullarda dengeyi kurmak için ileriye veya geriye yürür. Koşulların değişmesi nedeniyle bozulmuş olan bir dengenin kurulması için reaksiyonun kayacağı yön Le Chatelier ilkesi ile belirlenebilir. Bu ilke "dengedeki bir sisteme etki edildiğinde, sistem bu etkiyi azaltacak yönde kayar" şeklinde ifade edilebilir. Bu ilke kimyasal denge için de geçerlidir. 14
15 Derişim Dengede bulunan bir kimyasal reaksiyonda, reaktantlardan veya ürünlerden birinin veya birkaçının derişiminin değiştirilmesi dengeye dışardan yapılmış bir etkidir ve sonuçta denge bozulmuş olur. Bu da ileriye veya geriye yürüyen reaksiyonların hızlarının farklılaşmasından kaynaklanmaktadır. Sıcaklık Her kimyasal reaksiyona enerji değişimi eşlik eder ve çoğu zaman bu enerji değişimi ısı alış verişi şeklinde ortaya çıkar. Bilindiği gibi bir reaksiyonda dengeye, her iki yönden ulaşmak mümkündür. Basınç Reaksiyon ortamının basıncında yapılan bir değişikliğin mevcut dengenin bozularak yeni dengenin kurulmasına neden olup olmayacağı, ancak denkleştirilmiş reaksiyon denklemine ve bileşenlerin fiziksel hallerine bakılarak anlaşılabilir. H uzaklaştır N (g) + 3H (g) Le Chatelier derişimin değişimi Basınç artar NH 3 eklendiğinde denge hangi yöne kayar? NH 3 (g) NH 3 ekle H uzaklaştırılırsa denge hangi yöne ilerler? (kırmızı ok) Kabın basıncı artırılırsa denge hangi yöne kayar? (mavi ok) Le Chatelier sıcaklığın değişimi 1 Egzotermik reaksiyon N (g) + 3 H (g) NH 3 (g) H = - 9. kj Isı nerede? N (g) + 3 H (g) NH 3 (g) + ısı ISI EKLE N 3 H NH 3 ISI ISI UZAKLAŞTIR 15
16 Le Chatelier sıcaklığın değişimi Endotermik reaksiyon N O 4 NO H = kj Isı nerede? Le Chatelier Basınç ve Hacmin değişimi (gazlarda) A (g) + B (g) C (g) N O 4 + ısı NO Değişim Dengenin yönü Değişim Isı ekleme, sıcaklığı artırma Isı uzaklaştır, sıcaklığı azalt Egzotermik proses K azalır K artar Endotermik Proses K artar K azalır Basınç artışı Basınç düşüşü Hacim artışı Hacim azalışı Gazın mol sayısını azaltacak yönde En çok mol sayısına sahip yöne En çok mol sayısına sahip yöne En düşük mol sayısına sahip yöne Le Chatelier - Katalizör uncatalyzed catalyzed Katalizör, ileri veya geri reaksiyonu en düşük E a ile gerçekleştirir. Katalizör denge sabiti veya yönü üzerine bir etkiye sahip değildir 16
Bölüm 15 Kimyasal Denge. Denge Kavramı
 Öğrenme hedefleri ve temel beceriler: Bölüm 15 Kimyasal Denge Kimyasal denge ile ne kastedildiğini anlamak ve reaksiyon oranları ile nasıl ilgili olduğunu inceler Herhangi bir reaksiyon için denge sabiti
Öğrenme hedefleri ve temel beceriler: Bölüm 15 Kimyasal Denge Kimyasal denge ile ne kastedildiğini anlamak ve reaksiyon oranları ile nasıl ilgili olduğunu inceler Herhangi bir reaksiyon için denge sabiti
Kimyasal Reaksiyonlarda Hız
 Kimyasal Reaksiyonlarda Hız Yazar Yrd.Doç.Dr. Hayrettin TÜRK ÜNİTE 8 Amaçlar Bu üniteyi çalıştıktan sonra; basit reaksiyonlar ile reaksiyon mekanizmalarını öğrenecek, reaksiyon hız denklemlerini yazabilecek,
Kimyasal Reaksiyonlarda Hız Yazar Yrd.Doç.Dr. Hayrettin TÜRK ÜNİTE 8 Amaçlar Bu üniteyi çalıştıktan sonra; basit reaksiyonlar ile reaksiyon mekanizmalarını öğrenecek, reaksiyon hız denklemlerini yazabilecek,
KİMYASAL REAKSİYONLARDA DENGE
 KİMYASAL REAKSİYONLARDA DENGE KİMYASAL REAKSİYONLARDA DENGE Kimyasal reaksiyonlar koşullar uygun olduğunda hem ileri hem de geri yönde gerçekleşirler. Böyle tepkimelere tersinir ya da denge tepkimeleri
KİMYASAL REAKSİYONLARDA DENGE KİMYASAL REAKSİYONLARDA DENGE Kimyasal reaksiyonlar koşullar uygun olduğunda hem ileri hem de geri yönde gerçekleşirler. Böyle tepkimelere tersinir ya da denge tepkimeleri
KİMYA II DERS NOTLARI
 Yrd. Doç. Dr. Atilla EVCİN Afyonkarahisar Kocatepe Üniversitesi 007 KİMYA II DERS NOTLARI Yrd. Doç. Dr. Atilla EVCİN Yrd. Doç. Dr. Atilla EVCİN Afyonkarahisar Kocatepe Üniversitesi 007 Yrd. Doç. Dr. Atilla
Yrd. Doç. Dr. Atilla EVCİN Afyonkarahisar Kocatepe Üniversitesi 007 KİMYA II DERS NOTLARI Yrd. Doç. Dr. Atilla EVCİN Yrd. Doç. Dr. Atilla EVCİN Afyonkarahisar Kocatepe Üniversitesi 007 Yrd. Doç. Dr. Atilla
KİMYASAL KİNETİK. Bu notların hazırlanmasında başlıca,
 KİMYASAL KİNETİK İçindekiler Giriş Basit Reaksiyonlar ve Reaksiyon Mekanizması Molekül Çarpışmaları ve Etkinleşme Enerjisi Reaksiyon Hızı Reaksiyon Hız Denklemlerinin Yazılması Birinci, İkinci ve Sıfırıncı
KİMYASAL KİNETİK İçindekiler Giriş Basit Reaksiyonlar ve Reaksiyon Mekanizması Molekül Çarpışmaları ve Etkinleşme Enerjisi Reaksiyon Hızı Reaksiyon Hız Denklemlerinin Yazılması Birinci, İkinci ve Sıfırıncı
2.2 Birinci Derece Hız Sabiti ve Reaksiyonun Yarılanma Ömrü
 2.2 Birinci Derece Hız Sabiti ve Reaksiyonun Yarılanma Ömrü Birinci dereceden bir reaksiyonun hızı sadece bir reaktantın (veya ürünün) derişimine bağlıdır. Bu durumda reaksiyon hızı için, r=k[a]yazılabilir.
2.2 Birinci Derece Hız Sabiti ve Reaksiyonun Yarılanma Ömrü Birinci dereceden bir reaksiyonun hızı sadece bir reaktantın (veya ürünün) derişimine bağlıdır. Bu durumda reaksiyon hızı için, r=k[a]yazılabilir.
Aşağıda verilen özet bilginin ayrıntısını, ders. kitabı olarak önerilen, Erdik ve Sarıkaya nın. Temel Üniversitesi Kimyası Kitabı ndan
 KİMYASAL DENGE Aşağıda verilen özet bilginin ayrıntısını, ders kitabı olarak önerilen, Erdik ve Sarıkaya nın Temel Üniversitesi Kimyası Kitabı ndan okuyunuz.. Kimyasal denge, tepkimeye giren maddeler ve
KİMYASAL DENGE Aşağıda verilen özet bilginin ayrıntısını, ders kitabı olarak önerilen, Erdik ve Sarıkaya nın Temel Üniversitesi Kimyası Kitabı ndan okuyunuz.. Kimyasal denge, tepkimeye giren maddeler ve
KİMYASAL TEPKİMELERDE DENGE II
 KİMYASAL TEPKİMELERDE DENGE II Kimyasal tepkimelerde denge, sıcaklık, basınç ve denge bağıntısında yer alan maddelerin derişimlerine bağlıdır. Denge halindeki bir sistemde bu üç etkenden birini değiştirerek,
KİMYASAL TEPKİMELERDE DENGE II Kimyasal tepkimelerde denge, sıcaklık, basınç ve denge bağıntısında yer alan maddelerin derişimlerine bağlıdır. Denge halindeki bir sistemde bu üç etkenden birini değiştirerek,
5.111 Ders 34 Kinetik Konular: Sıcaklığın Etkisi, Çarpışma Teorisi, Aktifleşmiş Kompleks Teorisi. Bölüm
 34.1 5.111 Ders 34 Kinetik Konular: Sıcaklığın Etkisi, Çarpışma Teorisi, Aktifleşmiş Kompleks Teorisi. Bölüm 13.11-13.13 Tepkime Hızına Sıcaklığın Etkisi Gaz-Fazı Nitel (kalitatif) gözleme göre, sıcaklık
34.1 5.111 Ders 34 Kinetik Konular: Sıcaklığın Etkisi, Çarpışma Teorisi, Aktifleşmiş Kompleks Teorisi. Bölüm 13.11-13.13 Tepkime Hızına Sıcaklığın Etkisi Gaz-Fazı Nitel (kalitatif) gözleme göre, sıcaklık
KIMYASAL DENGE. Dinamik Denge. Denge Sabiti Eşitliği. Denge Sabiti Eşitliği. Denge Sabiti Eşitliği. Denge Sabiti Eşitliği
 Dinamik Denge KIMYASAL DENGE COMU, Egitim Fakültesi www.sakipkahraman.wordpress.com Bir sıvının buhar basıncı denge konumuna bağlı bir özelliktir. Çözünen bir katının çözünürlüğü denge konumuna bağlı bir
Dinamik Denge KIMYASAL DENGE COMU, Egitim Fakültesi www.sakipkahraman.wordpress.com Bir sıvının buhar basıncı denge konumuna bağlı bir özelliktir. Çözünen bir katının çözünürlüğü denge konumuna bağlı bir
3. KİMYASAL DENGE, (TERSİNİR REAKSİYONLAR)
 3. KİMYASAL DENGE, (TERSİNİR REAKSİYONLAR) Şu ana kadar ele aldığımız tüm değişimlere tek yönlü olaylar gözü ile bakmıştık. Oysa bazı fiziksel ve kimyasal olaylar, gerekirse koşulların da değiştirilmesi
3. KİMYASAL DENGE, (TERSİNİR REAKSİYONLAR) Şu ana kadar ele aldığımız tüm değişimlere tek yönlü olaylar gözü ile bakmıştık. Oysa bazı fiziksel ve kimyasal olaylar, gerekirse koşulların da değiştirilmesi
Katlı oranlar kanunu. 2H 2 + O 2 H 2 O Sabit Oran ( 4 g 32 g 36 g. 2 g 16 g 18 g. 1 g 8 g 9 g. 8 g 64 g 72 g. N 2 + 3H 2 2NH 3 Sabit Oran (
 Sabit oranlar kanunu Bir bileşiği oluşturan elementlerin kütleleri arasında sabit bir oran vardır. Bu sabit oranın varlığı ilk defa 799 tarihinde Praust tarafından bulunmuş ve sabit oranlar kanunu şeklinde
Sabit oranlar kanunu Bir bileşiği oluşturan elementlerin kütleleri arasında sabit bir oran vardır. Bu sabit oranın varlığı ilk defa 799 tarihinde Praust tarafından bulunmuş ve sabit oranlar kanunu şeklinde
3.BÖLÜM: TERMODİNAMİĞİN I. YASASI
 3.BÖLÜM: TERMODİNAMİĞİN I. YASASI S (k) + O SO + ısı Reaksiyon sonucunda sistemden ortama verilen ısı, sistemin iç enerjisinin bir kısmının ısı enerjisine dönüşmesi sonucunda ortaya çıkmıştır. Enerji sistemden
3.BÖLÜM: TERMODİNAMİĞİN I. YASASI S (k) + O SO + ısı Reaksiyon sonucunda sistemden ortama verilen ısı, sistemin iç enerjisinin bir kısmının ısı enerjisine dönüşmesi sonucunda ortaya çıkmıştır. Enerji sistemden
Kimyasal Kinetik. Kinetik. Reaksiyon Hızı. Reaksiyon Hızı. Reaksiyon Hızı. Reaksiyon Hızı. aa + bb cc + dd. Kinetik, bir reaksiyonun hızını inceler.
 Kinetik Kinetik, bir reaksiyonun hızını inceler. Kimyasal Kinetik Bir reaksiyon içinde geçen aşamaları, bu aşamaların oluş hızı ve hız üzerine reaksiyona giren maddelerin (reaktanların) ve reaksiyon sonucu
Kinetik Kinetik, bir reaksiyonun hızını inceler. Kimyasal Kinetik Bir reaksiyon içinde geçen aşamaları, bu aşamaların oluş hızı ve hız üzerine reaksiyona giren maddelerin (reaktanların) ve reaksiyon sonucu
DENGEYE ETKİ EDEN FAKTÖRLER
 DENGEYE ETKİ EDEN FAKTÖRLER Le Chatelier(Lö Şatölye İlkesi) Bu ilkeye göre ; denge halinde bulunan sisteme dışarıdan bir etki yapıldığında sistem kendiliğinden bu etkiyi azaltacak yönde eğilim gösterir.
DENGEYE ETKİ EDEN FAKTÖRLER Le Chatelier(Lö Şatölye İlkesi) Bu ilkeye göre ; denge halinde bulunan sisteme dışarıdan bir etki yapıldığında sistem kendiliğinden bu etkiyi azaltacak yönde eğilim gösterir.
Kimyasal Denge ÜNİTE. Amaçlar. İçindekiler. Yazar Yrd.Doç.Dr. Hayrettin TÜRK
 Kimyasal Denge Yazar Yrd.Doç.Dr. Hayrettin TÜRK ÜNİTE 10 Amaçlar Bu üniteyi çalıştıktan sonra; dengeye ulaşma sürecini öğrenecek, bir reaksiyon için denge sabiti bağıntısını yazabilecek, denge sabitinin
Kimyasal Denge Yazar Yrd.Doç.Dr. Hayrettin TÜRK ÜNİTE 10 Amaçlar Bu üniteyi çalıştıktan sonra; dengeye ulaşma sürecini öğrenecek, bir reaksiyon için denge sabiti bağıntısını yazabilecek, denge sabitinin
KİMYASAL TEPKİMELERDE HIZ
 KİMYASAL TEPKİMELERDE IZ TEPKİME IZI Kimyasal bir tepkime sırasında, tepkimeye giren maddelerin miktarı giderek azalırken, ürünlerin miktarı giderek artar. Bir tepkimede, birim zamanda harcanan ya da oluşan
KİMYASAL TEPKİMELERDE IZ TEPKİME IZI Kimyasal bir tepkime sırasında, tepkimeye giren maddelerin miktarı giderek azalırken, ürünlerin miktarı giderek artar. Bir tepkimede, birim zamanda harcanan ya da oluşan
ÖĞRETĐM TEKNOLOJĐLERĐ VE MATERYAL GELĐŞĐMĐ ÇALIŞMA YAPRAĞI
 ÖĞRETĐM TEKNOLOJĐLERĐ VE MATERYAL GELĐŞĐMĐ ÇALIŞMA YAPRAĞI REAKSĐYON HIZINA ETKĐ EDEN FAKTÖRLER YASEMĐN KONMAZ 20338575 Çalışma Yaprağı Ders Anlatımı: REAKSĐYON HIZINA ETKĐ EDEN FAKTÖRLER: 1.Reaktif Maddelerin
ÖĞRETĐM TEKNOLOJĐLERĐ VE MATERYAL GELĐŞĐMĐ ÇALIŞMA YAPRAĞI REAKSĐYON HIZINA ETKĐ EDEN FAKTÖRLER YASEMĐN KONMAZ 20338575 Çalışma Yaprağı Ders Anlatımı: REAKSĐYON HIZINA ETKĐ EDEN FAKTÖRLER: 1.Reaktif Maddelerin
BÖLÜM 19 KİMYASAL TERMODİNAMİK ENTROPİ VE SERBEST ENERJİ Öğrenme Hedefleri ve Anahtar Kavramlar: Kendiliğinden, tersinir, tersinmez ve izotermal
 BÖLÜM 19 KİMYASAL TERMODİNAMİK ENTROPİ VE SERBEST ENERJİ Öğrenme Hedefleri ve Anahtar Kavramlar: Kendiliğinden, tersinir, tersinmez ve izotermal tepkime kavramlarının anlaşılması Termodinamiğin II. yasasının
BÖLÜM 19 KİMYASAL TERMODİNAMİK ENTROPİ VE SERBEST ENERJİ Öğrenme Hedefleri ve Anahtar Kavramlar: Kendiliğinden, tersinir, tersinmez ve izotermal tepkime kavramlarının anlaşılması Termodinamiğin II. yasasının
Kimyasal Termodinamik
 Kimyasal Termodinamik MÜHENDİSLİK KİMYASI DERS NOTLARI Yrd. Doç. Dr. Atilla EVCİN Çevremizde neler oluyor? Su neden buharlaşıyor? Sıcak nesneler neden soğuyor? Bazı moleküller diğerleriyle reaksiyona girerken,
Kimyasal Termodinamik MÜHENDİSLİK KİMYASI DERS NOTLARI Yrd. Doç. Dr. Atilla EVCİN Çevremizde neler oluyor? Su neden buharlaşıyor? Sıcak nesneler neden soğuyor? Bazı moleküller diğerleriyle reaksiyona girerken,
KİMYA II DERS NOTLARI
 Yr. Doç. Dr. Atilla EVCİN Afyonkarahisar ocatepe Üniversitesi 007 Reaksiyon hızı ve enge arasınaki bağlantı İMYA II DERS NOTLARI Yr. Doç. Dr. Atilla EVCİN İleri Reak.: A B Geri Reak.: B A hız k i [A] hız
Yr. Doç. Dr. Atilla EVCİN Afyonkarahisar ocatepe Üniversitesi 007 Reaksiyon hızı ve enge arasınaki bağlantı İMYA II DERS NOTLARI Yr. Doç. Dr. Atilla EVCİN İleri Reak.: A B Geri Reak.: B A hız k i [A] hız
YANMA. Derlenmiş Notlar. Mustafa Eyriboyun ZKÜ - 2009
 YANMA Derlenmiş Notlar Mustafa Eyriboyun ZKÜ - 2009 FAZ DENGESĐ Denge çözümlerinde, yanma sonrası ürün konsantrasyonlarının hesaplanmasında üç farklı yöntem kullanılabilir (Pratt and Wormeck, 1976): Bunlar,
YANMA Derlenmiş Notlar Mustafa Eyriboyun ZKÜ - 2009 FAZ DENGESĐ Denge çözümlerinde, yanma sonrası ürün konsantrasyonlarının hesaplanmasında üç farklı yöntem kullanılabilir (Pratt and Wormeck, 1976): Bunlar,
GAZLAR GAZ KARIŞIMLARI
 DALTON KISMİ BASINÇLAR YASASI Aynı Kaplarda Gazların Karıştırılması Birbiri ile tepkimeye girmeyen gaz karışımlarının davranışı genellikle ilgi çekicidir. Böyle bir karışımdaki bir bileşenin basıncı, aynı
DALTON KISMİ BASINÇLAR YASASI Aynı Kaplarda Gazların Karıştırılması Birbiri ile tepkimeye girmeyen gaz karışımlarının davranışı genellikle ilgi çekicidir. Böyle bir karışımdaki bir bileşenin basıncı, aynı
KİMYASAL DENGE. AMAÇ Bu deneyin amacı öğrencilerin reaksiyon denge sabitini,k, deneysel olarak bulmalarıdır.
 KİMYASAL DENGE AMAÇ Bu deneyin amacı öğrencilerin reaksiyon denge sabitini,k, deneysel olarak bulmalarıdır. TEORİ Bir kimyasal tepkimenin yönü bazı reaksiyonlar için tek bazıları için ise çift yönlüdür.
KİMYASAL DENGE AMAÇ Bu deneyin amacı öğrencilerin reaksiyon denge sabitini,k, deneysel olarak bulmalarıdır. TEORİ Bir kimyasal tepkimenin yönü bazı reaksiyonlar için tek bazıları için ise çift yönlüdür.
FİZİKOKİMYA I ARASINAV SORU VE CEVAPLARI 2013-14 GÜZ YARIYILI
 Soru 1: Aşağıdaki ifadeleri tanımlayınız. a) Sistem b)adyabatik sistem c) Kapalı sistem c) Bileşen analizi Cevap 1: a) Sistem: Üzerinde araştırma yapmak üzere sınırladığımız bir evren parçasına verilen
Soru 1: Aşağıdaki ifadeleri tanımlayınız. a) Sistem b)adyabatik sistem c) Kapalı sistem c) Bileşen analizi Cevap 1: a) Sistem: Üzerinde araştırma yapmak üzere sınırladığımız bir evren parçasına verilen
İDEAL GAZ KARIŞIMLARI
 İdeal Gaz Karışımları İdeal gaz karışımları saf ideal gazlar gibi davranırlar. Saf gazlardan n 1, n 2,, n i, mol alınarak hazırlanan bir karışımın toplam basıncı p, toplam hacmi v ve sıcaklığı T olsun.
İdeal Gaz Karışımları İdeal gaz karışımları saf ideal gazlar gibi davranırlar. Saf gazlardan n 1, n 2,, n i, mol alınarak hazırlanan bir karışımın toplam basıncı p, toplam hacmi v ve sıcaklığı T olsun.
Üçüncü Tek Saatlik Sınav 5.111
 Sayfa 1 /10 Üçüncü Tek Saatlik Sınav 5.111 İsminizi aşağıya yazınız. Sınavda kitaplarınız kapalı olacaktır. 6 problemi de çözmelisiniz. Bir problemin bütün şıklarını baştan sona dikkatli bir şekilde okuyunuz.
Sayfa 1 /10 Üçüncü Tek Saatlik Sınav 5.111 İsminizi aşağıya yazınız. Sınavda kitaplarınız kapalı olacaktır. 6 problemi de çözmelisiniz. Bir problemin bütün şıklarını baştan sona dikkatli bir şekilde okuyunuz.
TERMODİNAMİĞİN BİRİNCİ YASASI
 İç Enerji Fonksiyonu ve C v Isınma Isısı Kimyasal tepkimelerin olmadığı kapalı sistemlerde kütle yanında molar miktar da sabit kalmaktadır. Madde miktarı n mol olan kapalı bir ideal gaz sistemi düşünelim.
İç Enerji Fonksiyonu ve C v Isınma Isısı Kimyasal tepkimelerin olmadığı kapalı sistemlerde kütle yanında molar miktar da sabit kalmaktadır. Madde miktarı n mol olan kapalı bir ideal gaz sistemi düşünelim.
Enerji iş yapabilme kapasitesidir. Kimyacı işi bir süreçten kaynaklanan enerji deyişimi olarak tanımlar.
 Kinetik ve Potansiyel Enerji Enerji iş yapabilme kapasitesidir. Kimyacı işi bir süreçten kaynaklanan enerji deyişimi olarak tanımlar. Işıma veya Güneş Enerjisi Isı Enerjisi Kimyasal Enerji Nükleer Enerji
Kinetik ve Potansiyel Enerji Enerji iş yapabilme kapasitesidir. Kimyacı işi bir süreçten kaynaklanan enerji deyişimi olarak tanımlar. Işıma veya Güneş Enerjisi Isı Enerjisi Kimyasal Enerji Nükleer Enerji
Modül 8 Kimyasal Kinetik
 Chemistry, The Central Science, 10th edition Theodore L. Brown; H. Eugene LeMay, Jr.; and Bruce E. Bursten Modül 8 Kimyasal Kinetik Doç.Dr.Levent ÇAVAŞ Dokuz Eylül Üniversitesi Fen Edebiyat Fakültesi Kimya
Chemistry, The Central Science, 10th edition Theodore L. Brown; H. Eugene LeMay, Jr.; and Bruce E. Bursten Modül 8 Kimyasal Kinetik Doç.Dr.Levent ÇAVAŞ Dokuz Eylül Üniversitesi Fen Edebiyat Fakültesi Kimya
GENEL KİMYA 101 ÖDEV 3
 TOBB EKONOMİ VE TEKNOLOJİ ÜNİVERSİTESİ-27 Kasım 2013 Bütün Şubeler GENEL KİMYA 101 ÖDEV 3 ÖNEMLİ! Ödev Teslim Tarihi: 6 Aralık 2013 Soru 1-5 arasında 2 soru Soru 6-10 arasında 2 soru Soru 11-15 arasında
TOBB EKONOMİ VE TEKNOLOJİ ÜNİVERSİTESİ-27 Kasım 2013 Bütün Şubeler GENEL KİMYA 101 ÖDEV 3 ÖNEMLİ! Ödev Teslim Tarihi: 6 Aralık 2013 Soru 1-5 arasında 2 soru Soru 6-10 arasında 2 soru Soru 11-15 arasında
İnstagram:kimyaci_glcn_hoca 8.HAMLE İNSTAGRAM: kimyaci_glcn_hoca
 13 H A M L E D E 8.HAMLE KİMYASAL REAKSİYONLARDA DENGE Denge Hali; *Sabit sıcaklıkta kapalı sistemlerde renk, basınç... gibi gözlenebilen özelliklerin değişmez duruma gelmesiyle kurulur. * Çift yönlü (tersinir)
13 H A M L E D E 8.HAMLE KİMYASAL REAKSİYONLARDA DENGE Denge Hali; *Sabit sıcaklıkta kapalı sistemlerde renk, basınç... gibi gözlenebilen özelliklerin değişmez duruma gelmesiyle kurulur. * Çift yönlü (tersinir)
ÇEVRE MÜHENDĠSLĠĞĠ BÖLÜMÜ 0010020036 KODLU TEMEL ĠġLEMLER-1 LABORATUVAR DERSĠ DENEY FÖYÜ
 DENEY NO: 5 HAVAANDIRMA ÇEVRE MÜHENDĠSĠĞĠ BÖÜMÜ Çevre Mühendisi atmosfer şartlarında suda çözünmüş oksijen ile yakından ilgilidir. Çözünmüş oksijen (Ç.O) su içinde çözünmüş halde bulunan oksijen konsantrasyonu
DENEY NO: 5 HAVAANDIRMA ÇEVRE MÜHENDĠSĠĞĠ BÖÜMÜ Çevre Mühendisi atmosfer şartlarında suda çözünmüş oksijen ile yakından ilgilidir. Çözünmüş oksijen (Ç.O) su içinde çözünmüş halde bulunan oksijen konsantrasyonu
BÖLÜM 14 Kimyasal Kinetik
 Öğrenme Amaçları ve Temel Beceriler: BÖLÜM 14 Kimyasal Kinetik Kimyasal reaksiyonların hızına etki eden faktörleri anlamak. Tepkimelerin reaksiyon hızını ve konsantrasyonunu belirlemek. Ürün oluşum hızı
Öğrenme Amaçları ve Temel Beceriler: BÖLÜM 14 Kimyasal Kinetik Kimyasal reaksiyonların hızına etki eden faktörleri anlamak. Tepkimelerin reaksiyon hızını ve konsantrasyonunu belirlemek. Ürün oluşum hızı
REAKSİYON HIZI. Tepkimede yer alan maddelerin derişimleri köşeli parantez ile gösterilir.
 REAKSİYON HIZI REAKSİYON HIZI Bir reaksiyonun hızlı ya da yavaş olması, reaksiyona giren maddelerin cinsine ve miktarına bağlıdır. Bu nedenle bütün reaksiyonlar farklı hızlarda gerçekleşirler. Örneğin;
REAKSİYON HIZI REAKSİYON HIZI Bir reaksiyonun hızlı ya da yavaş olması, reaksiyona giren maddelerin cinsine ve miktarına bağlıdır. Bu nedenle bütün reaksiyonlar farklı hızlarda gerçekleşirler. Örneğin;
Kimya Mühendisliği Bölümü, 2014/2015 Öğretim Yılı, Bahar Yarıyılı 0102-Genel Kimya-II Dersi, Dönem Sonu Sınavı
 Kimya Mühendisliği Bölümü, 2014/2015 Öğretim Yılı, Bahar Yarıyılı 0102-Genel Kimya-II Dersi, Dönem Sonu Sınavı 20.05.2015 Soru (puan) 1 (20 ) 2 (20 ) 3 (20 ) 4 (25) 5 (20 ) 6 (20 ) Toplam Alınan Puan Not:
Kimya Mühendisliği Bölümü, 2014/2015 Öğretim Yılı, Bahar Yarıyılı 0102-Genel Kimya-II Dersi, Dönem Sonu Sınavı 20.05.2015 Soru (puan) 1 (20 ) 2 (20 ) 3 (20 ) 4 (25) 5 (20 ) 6 (20 ) Toplam Alınan Puan Not:
Termodinamik Termodinamik Süreçlerde İŞ ve ISI
 Termodinamik Süreçlerde İŞ ve ISI Termodinamik Hareketli bir pistonla bağlantılı bir silindirik kap içindeki gazı inceleyelim (Şekil e bakınız). Denge halinde iken, hacmi V olan gaz, silindir çeperlerine
Termodinamik Süreçlerde İŞ ve ISI Termodinamik Hareketli bir pistonla bağlantılı bir silindirik kap içindeki gazı inceleyelim (Şekil e bakınız). Denge halinde iken, hacmi V olan gaz, silindir çeperlerine
Termal Genleşme İdeal Gazlar Isı Termodinamiğin 1. Yasası Entropi ve Termodinamiğin 2. Yasası
 Termal Genleşme İdeal Gazlar Isı Termodinamiğin 1. Yasası Entropi ve Termodinamiğin 2. Yasası Sıcaklık, bir gaz molekülünün kütle merkezi hareketinin ortalama kinetic enerjisinin bir ölçüsüdür. Sıcaklık,
Termal Genleşme İdeal Gazlar Isı Termodinamiğin 1. Yasası Entropi ve Termodinamiğin 2. Yasası Sıcaklık, bir gaz molekülünün kütle merkezi hareketinin ortalama kinetic enerjisinin bir ölçüsüdür. Sıcaklık,
FİZİKSEL KİMYA I FİNAL SINAVI
 FİZİKSEL KİMYA I FİNAL SINAVI 21.08.2015 NO : AD SOYAD : İMZA SORU NO 1 2 3 4 5 Toplam PUAN Yalnızca 4 soruyu yanıtlayınız. Yanıtlamadığınız sorunun PUAN kısmına çarpı koyunuz. Aksi taktirde 5. Soru değerlendirme
FİZİKSEL KİMYA I FİNAL SINAVI 21.08.2015 NO : AD SOYAD : İMZA SORU NO 1 2 3 4 5 Toplam PUAN Yalnızca 4 soruyu yanıtlayınız. Yanıtlamadığınız sorunun PUAN kısmına çarpı koyunuz. Aksi taktirde 5. Soru değerlendirme
KİNETİK GAZ KURAMI. Doç. Dr. Faruk GÖKMEŞE Kimya Bölümü Hitit Üniversitesi Fen Edebiyat Fakültesi 1
 Kinetik Gaz Kuramının Varsayımları Boyle, Gay-Lussac ve Avagadro deneyleri tüm ideal gazların aynı davrandığını göstermektedir ve bunları açıklamak üzere kinetik gaz kuramı ortaya atılmıştır. 1. Gazlar
Kinetik Gaz Kuramının Varsayımları Boyle, Gay-Lussac ve Avagadro deneyleri tüm ideal gazların aynı davrandığını göstermektedir ve bunları açıklamak üzere kinetik gaz kuramı ortaya atılmıştır. 1. Gazlar
5. P.E(kj) I. Reaktifler uygun geometride çarpışmalıdır. II. Çarpışan tanecikler yeterli aktivasyon enerjisine sahip olmalıdır.
 Kimyasal Tepkimelerde Hız ve Denge / Tepkimelerde Hız / Tepkime Hızının Ölçülmesi BÖLÜM 6 Test. Kimyasal tepkimelerin gerçekleşebilmesi için, I. Reaktifler uygun geometride çarpışmalıdır. II. Çarpışan
Kimyasal Tepkimelerde Hız ve Denge / Tepkimelerde Hız / Tepkime Hızının Ölçülmesi BÖLÜM 6 Test. Kimyasal tepkimelerin gerçekleşebilmesi için, I. Reaktifler uygun geometride çarpışmalıdır. II. Çarpışan
KİNETİK GAZ KURAMI. Doç. Dr. Faruk GÖKMEŞE Kimya Bölümü Hitit Üniversitesi Fen Edebiyat Fakültesi 1
 Kinetik Gaz Kuramından Gazların Isınma Isılarının Bulunması Sabit hacimdeki ısınma ısısı (C v ): Sabit hacimde bulunan bir mol gazın sıcaklığını 1K değiştirmek için gerekli ısı alışverişi. Sabit basınçtaki
Kinetik Gaz Kuramından Gazların Isınma Isılarının Bulunması Sabit hacimdeki ısınma ısısı (C v ): Sabit hacimde bulunan bir mol gazın sıcaklığını 1K değiştirmek için gerekli ısı alışverişi. Sabit basınçtaki
TERMODİNAMİĞİN TEMEL EŞİTLİKLERİ
 Serbest İç Enerji (Helmholtz Enerjisi) Ve Serbest Entalpi (Gibbs Enerjisi) Fonksiyonları İç enerji ve entalpi fonksiyonları yalnızca termodinamiğin birinci yasasından tanımlanır. Entropi fonksiyonu yalnızca
Serbest İç Enerji (Helmholtz Enerjisi) Ve Serbest Entalpi (Gibbs Enerjisi) Fonksiyonları İç enerji ve entalpi fonksiyonları yalnızca termodinamiğin birinci yasasından tanımlanır. Entropi fonksiyonu yalnızca
Termokimya ÜNİTE. Amaçlar. İçindekiler. Yazar Yrd.Doç.Dr. Hayrettin TÜRK
 Termokimya Yazar Yrd.Doç.Dr. Hayrettin TÜRK ÜNİTE 9 Amaçlar Bu üniteyi çalıştıktan sonra; kimyasal reaksiyonlarda iç enerji ve entalpi değişimlerini öğrenecek, kalorimetre ve reaksiyon ısısı hakkında bilgi
Termokimya Yazar Yrd.Doç.Dr. Hayrettin TÜRK ÜNİTE 9 Amaçlar Bu üniteyi çalıştıktan sonra; kimyasal reaksiyonlarda iç enerji ve entalpi değişimlerini öğrenecek, kalorimetre ve reaksiyon ısısı hakkında bilgi
BÖLÜM 1: TEMEL KAVRAMLAR
 Sistem ve Hal Değişkenleri Üzerinde araştırma yapmak üzere sınırladığımız bir evren parçasına sistem, bu sistemi çevreleyen yere is ortam adı verilir. İzole sistem; Madde ve her türden enerji akışına karşı
Sistem ve Hal Değişkenleri Üzerinde araştırma yapmak üzere sınırladığımız bir evren parçasına sistem, bu sistemi çevreleyen yere is ortam adı verilir. İzole sistem; Madde ve her türden enerji akışına karşı
KĠMYASAL TEPKĠMELERDE DENGE
 KĠMYASAL TEPKĠMELERDE DENGE Fiziksel ve kimyasal olaylarda tepkimeye giren maddelerin miktarı zamanla azalırken, ürünlerin miktarı zamanla artar. Tam verimle gerçekleşen tepkimelerde, tepkimeye giren maddelerden
KĠMYASAL TEPKĠMELERDE DENGE Fiziksel ve kimyasal olaylarda tepkimeye giren maddelerin miktarı zamanla azalırken, ürünlerin miktarı zamanla artar. Tam verimle gerçekleşen tepkimelerde, tepkimeye giren maddelerden
Sıcaklık (Temperature):
 Sıcaklık (Temperature): Sıcaklık tanım olarak bir maddenin yapısındaki molekül veya atomların ortalama kinetik enerjilerinin ölçüm değeridir. Sıcaklık t veya T ile gösterilir. Termometre kullanılarak ölçülür.
Sıcaklık (Temperature): Sıcaklık tanım olarak bir maddenin yapısındaki molekül veya atomların ortalama kinetik enerjilerinin ölçüm değeridir. Sıcaklık t veya T ile gösterilir. Termometre kullanılarak ölçülür.
GENEL KİMYA. 7. Konu: Kimyasal reaksiyonlar, Kimyasal eşitlikler, Kimyasal tepkime türleri, Kimyasal Hesaplamalar
 GENEL KİMYA 7. Konu: Kimyasal reaksiyonlar, Kimyasal eşitlikler, Kimyasal tepkime türleri, Kimyasal Hesaplamalar Kimyasal Reaksiyonlar Kimyasal reaksiyon (tepkime), kimyasal maddelerdeki kimyasal değişme
GENEL KİMYA 7. Konu: Kimyasal reaksiyonlar, Kimyasal eşitlikler, Kimyasal tepkime türleri, Kimyasal Hesaplamalar Kimyasal Reaksiyonlar Kimyasal reaksiyon (tepkime), kimyasal maddelerdeki kimyasal değişme
ÇÖZÜNÜRLÜĞE ETKİ EDEN FAKTÖRLER
 ÇÖZÜNÜRLÜĞE ETKİ EDEN FAKTÖRLER 1- SICAKLIK 2- ORTAK İYON ETKİSİ 3- ÇÖZÜCÜ ÇÖZÜNEN CİNSİ 4- BASINCIN ETKİSİ 1- SICAKLIK ETKİSİ Sıcaklık etkisi Le Chatelier prensibine bağlı olarak yorumlanır. ENDOTERMİK
ÇÖZÜNÜRLÜĞE ETKİ EDEN FAKTÖRLER 1- SICAKLIK 2- ORTAK İYON ETKİSİ 3- ÇÖZÜCÜ ÇÖZÜNEN CİNSİ 4- BASINCIN ETKİSİ 1- SICAKLIK ETKİSİ Sıcaklık etkisi Le Chatelier prensibine bağlı olarak yorumlanır. ENDOTERMİK
E = U + KE + KP = (kj) U = iç enerji, KE = kinetik enerji, KP = potansiyel enerji, m = kütle, V = hız, g = yerçekimi ivmesi, z = yükseklik
 Enerji (Energy) Enerji, iş yapabilme kabiliyetidir. Bir sistemin enerjisi, o sistemin yapabileceği azami iştir. İş, bir cisme, bir kuvvetin tesiri ile yol aldırma, yerini değiştirme şeklinde tarif edilir.
Enerji (Energy) Enerji, iş yapabilme kabiliyetidir. Bir sistemin enerjisi, o sistemin yapabileceği azami iştir. İş, bir cisme, bir kuvvetin tesiri ile yol aldırma, yerini değiştirme şeklinde tarif edilir.
HACETTEPE ÜNĐVERSĐTESĐ PROJE TABANLI DENEY UYGULAMALARI KONU : KĐMYASAL TEPKĐMELERDE ENERJĐ VE HIZ
 HACETTEPE ÜNĐVERSĐTESĐ PROJE TABANLI DENEY UYGULAMALARI KONU : KĐMYASAL TEPKĐMELERDE ENERJĐ VE HIZ MERMERĐN(CaCO 3 ) in SEYRELTĐK HCl ĐLE REAKSĐYONU DERS : ORTA ÖĞRETĐM KĐMYA DENEYLERĐ DERS SORUMLUSU :
HACETTEPE ÜNĐVERSĐTESĐ PROJE TABANLI DENEY UYGULAMALARI KONU : KĐMYASAL TEPKĐMELERDE ENERJĐ VE HIZ MERMERĐN(CaCO 3 ) in SEYRELTĐK HCl ĐLE REAKSĐYONU DERS : ORTA ÖĞRETĐM KĐMYA DENEYLERĐ DERS SORUMLUSU :
Hidroklorik asit ve sodyum hidroksitin reaksiyonundan yemek tuzu ve su meydana gelir. Bu kimyasal olayın denklemi
 KİMYASAL DENKLEMLER İki ya da daha fazla maddenin birbirleri ile etkileşerek kendi özelliklerini kaybedip yeni özelliklerde bir takım ürünler meydana getirmesine kimyasal olay, bunların formüllerle gösterilmesine
KİMYASAL DENKLEMLER İki ya da daha fazla maddenin birbirleri ile etkileşerek kendi özelliklerini kaybedip yeni özelliklerde bir takım ürünler meydana getirmesine kimyasal olay, bunların formüllerle gösterilmesine
BÖLÜM 1: TEMEL KAVRAMLAR
 BÖLÜM 1: TEMEL KAVRAMLAR Hal Değişkenleri Arasındaki Denklemler Aralarında sıfıra eşitlenebilen en az bir veya daha fazla denklem kurulabilen değişkenler birbirine bağımlıdır. Bu denklemlerden bilinen
BÖLÜM 1: TEMEL KAVRAMLAR Hal Değişkenleri Arasındaki Denklemler Aralarında sıfıra eşitlenebilen en az bir veya daha fazla denklem kurulabilen değişkenler birbirine bağımlıdır. Bu denklemlerden bilinen
ÇÖZELTİLERİN KOLİGATİF ÖZELLİKLERİ
 ÇÖZELTİLERİN KOLİGATİF ÖZELLİKLERİ Çözeltilerin sadece derişimine bağlı olarak değişen özelliklerine koligatif özellikler denir. Buhar basıncı düşmesi, Kaynama noktası yükselmesi, Donma noktası azalması
ÇÖZELTİLERİN KOLİGATİF ÖZELLİKLERİ Çözeltilerin sadece derişimine bağlı olarak değişen özelliklerine koligatif özellikler denir. Buhar basıncı düşmesi, Kaynama noktası yükselmesi, Donma noktası azalması
a. Yükseltgenme potansiyeli büyük olanlar daha aktifdir.
 ELEKTROKİMYA A. AKTİFLİK B. PİLLER C. ELEKTROLİZ A. AKTİFLİK Metallerin elektron verme, ametallerin elektron alma yatkınlıklarına aktiflik denir. Yani bir metal ne kadar kolay elektron veriyorsa bir ametal
ELEKTROKİMYA A. AKTİFLİK B. PİLLER C. ELEKTROLİZ A. AKTİFLİK Metallerin elektron verme, ametallerin elektron alma yatkınlıklarına aktiflik denir. Yani bir metal ne kadar kolay elektron veriyorsa bir ametal
Akışkanların Dinamiği
 Akışkanların Dinamiği Akışkanların Dinamiğinde Kullanılan Temel Prensipler Gaz ve sıvı akımıyla ilgili bütün problemlerin çözümü kütlenin korunumu, enerjinin korunumu ve momentumun korunumu prensibe dayanır.
Akışkanların Dinamiği Akışkanların Dinamiğinde Kullanılan Temel Prensipler Gaz ve sıvı akımıyla ilgili bütün problemlerin çözümü kütlenin korunumu, enerjinin korunumu ve momentumun korunumu prensibe dayanır.
GENEL KİMYA. Yrd.Doç.Dr. Tuba YETİM
 GENEL KİMYA ÇÖZELTİLER Homojen karışımlara çözelti denir. Çözelti bileşiminin ve özelliklerinin çözeltinin her yerinde aynı olması sebebiyle çözelti, «homojen» olarak nitelendirilir. Çözeltinin değişen
GENEL KİMYA ÇÖZELTİLER Homojen karışımlara çözelti denir. Çözelti bileşiminin ve özelliklerinin çözeltinin her yerinde aynı olması sebebiyle çözelti, «homojen» olarak nitelendirilir. Çözeltinin değişen
Antosiyanin İçeriği (mg/l)
 Doç. Dr. H. Ali GÜLEÇ Araş. Gör. Kadir ÇINAR Trakya Üniversitesi Gıda Mühendisliği Bölümü TEPKİME KİNETİĞİ SORU SETİ-1 1. 160 mg/l düzeyinde antosiyanin içeren vişne suyunun 80 C da sabit sıcaklıkta ısıtılması
Doç. Dr. H. Ali GÜLEÇ Araş. Gör. Kadir ÇINAR Trakya Üniversitesi Gıda Mühendisliği Bölümü TEPKİME KİNETİĞİ SORU SETİ-1 1. 160 mg/l düzeyinde antosiyanin içeren vişne suyunun 80 C da sabit sıcaklıkta ısıtılması
Kimya ve Enerji. 1. Sistem ve Çevre. 2. Isı, Mekanik İş ve İç Enerji. YKS Fasikülleri. Yakup Demir. a. Sistemlerin
 Bu notlara Youtube dan Kimya Elbistan kanalında ilgili videolarının açıklamalar kısmında ki linkten ücretsiz bir şekilde ulaşabilirsiniz. Fiziksel ve kimyasal değişimlerde meydana gelen ısı değişimini
Bu notlara Youtube dan Kimya Elbistan kanalında ilgili videolarının açıklamalar kısmında ki linkten ücretsiz bir şekilde ulaşabilirsiniz. Fiziksel ve kimyasal değişimlerde meydana gelen ısı değişimini
Fiziksel özellikleri her yerde aynı olan (homojen) karışımlara çözelti denir. Bir çözeltiyi oluşturan her bir maddeye çözeltinin bileşenleri denir.
 GENEL KİMYA 1 LABORATUARI ÇALIŞMA NOTLARI DENEY: 8 ÇÖZELTİLER Dr. Bahadır KESKİN, 2011 @ YTÜ Fiziksel özellikleri her yerde aynı olan (homojen) karışımlara çözelti denir. Bir çözeltiyi oluşturan her bir
GENEL KİMYA 1 LABORATUARI ÇALIŞMA NOTLARI DENEY: 8 ÇÖZELTİLER Dr. Bahadır KESKİN, 2011 @ YTÜ Fiziksel özellikleri her yerde aynı olan (homojen) karışımlara çözelti denir. Bir çözeltiyi oluşturan her bir
Aeresol. Süspansiyon. Heterojen Emülsiyon. Karışım. Kolloidal. Çözelti < 10-9 m Süspansiyon > 10-6 m Kolloid 10-9 m m
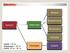 Aeresol Süspansiyon Karışım Heterojen Emülsiyon Kolloidal Çözelti < 10-9 m Süspansiyon > 10-6 m Kolloid 10-9 m - 10-6 m Homojen Çözelti Dağılan Faz Dağılma Fazı Kolloid Tipi katı katı,sıvı,gaz sol katı
Aeresol Süspansiyon Karışım Heterojen Emülsiyon Kolloidal Çözelti < 10-9 m Süspansiyon > 10-6 m Kolloid 10-9 m - 10-6 m Homojen Çözelti Dağılan Faz Dağılma Fazı Kolloid Tipi katı katı,sıvı,gaz sol katı
SINAV SÜRESİ 90 DAKİKADIR. BAŞARILAR
 FİZİKSEL KİMYA I FİAL SIAVI 0.0.0 : AD SYAD : İMZA SRU 5 Toplam PUA 0. Zn(k) + C(g) ----> Zn(g) + C (g) reaksiyonu için standart reaksiyon entalpisinin sıcaklığa bağımlılığı olduğuna göre reaksiyon için;
FİZİKSEL KİMYA I FİAL SIAVI 0.0.0 : AD SYAD : İMZA SRU 5 Toplam PUA 0. Zn(k) + C(g) ----> Zn(g) + C (g) reaksiyonu için standart reaksiyon entalpisinin sıcaklığa bağımlılığı olduğuna göre reaksiyon için;
Akışkanların Dinamiği
 Akışkanların Dinamiği Akışkanların Dinamiğinde Kullanılan Temel Prensipler Gaz ve sıvı akımıyla ilgili bütün problemlerin çözümü kütlenin korunumu, enerjinin korunumu ve momentumun korunumu prensibe dayanır.
Akışkanların Dinamiği Akışkanların Dinamiğinde Kullanılan Temel Prensipler Gaz ve sıvı akımıyla ilgili bütün problemlerin çözümü kütlenin korunumu, enerjinin korunumu ve momentumun korunumu prensibe dayanır.
Burada a, b, c ve d katsayılar olup genelde birer tamsayıdır. Benzer şekilde 25 o C de hidrojen ve oksijen gazlarından suyun oluşumu; H 2 O (s)
 1 Kimyasal Tepkimeler Kimyasal olaylar elementlerin birbirleriyle etkileşip elektron alışverişi yapmaları sonucu oluşan olaylardır. Bu olaylar neticesinde bir bileşikteki atomların sayısı, dizilişi, bağ
1 Kimyasal Tepkimeler Kimyasal olaylar elementlerin birbirleriyle etkileşip elektron alışverişi yapmaları sonucu oluşan olaylardır. Bu olaylar neticesinde bir bileşikteki atomların sayısı, dizilişi, bağ
Bölüm 2. Sıcaklık ve Gazların Kinetik Teorisi. Prof. Dr. Bahadır BOYACIOĞLU
 Bölüm 2 Sıcaklık ve Gazların Kinetik Teorisi Prof. Dr. Bahadır BOYACIOĞLU Sıcaklık ve Gazların Kinetik Teorisi Gazlarda Basınç Gaz Yasaları İdeal Gaz Yasası Gazlarda Basınç Gazlar parçacıklar arasında
Bölüm 2 Sıcaklık ve Gazların Kinetik Teorisi Prof. Dr. Bahadır BOYACIOĞLU Sıcaklık ve Gazların Kinetik Teorisi Gazlarda Basınç Gaz Yasaları İdeal Gaz Yasası Gazlarda Basınç Gazlar parçacıklar arasında
GENEL KİMYA. Yrd.Doç.Dr. Tuba YETİM
 GENEL KİMYA KİMYASAL REAKSİYONLAR Kimyasal Tepkime Kimyasal tepkime, Bir ya da birkaç maddenin (tepkenler) yeni bir bileşik grubuna (ürünler) dönüştürülmesi işlemidir. Tepkenler Ürünler NO + 1/2 O 2 NO
GENEL KİMYA KİMYASAL REAKSİYONLAR Kimyasal Tepkime Kimyasal tepkime, Bir ya da birkaç maddenin (tepkenler) yeni bir bileşik grubuna (ürünler) dönüştürülmesi işlemidir. Tepkenler Ürünler NO + 1/2 O 2 NO
KİMYASAL REAKSİYON MÜHENDİSLİĞİ
 KİMYSL REKSİYON MÜHENDİSLİĞİ KMM 3262 Hafta Konular 1 Kimyasal reaksiyon mühendisliğine giriş, Kesikli ve akışlı reaktörlerin tasarım eşitliklerinin belirlenmesi, 2 Genel mol denkliği; Kesikli, sürekli
KİMYSL REKSİYON MÜHENDİSLİĞİ KMM 3262 Hafta Konular 1 Kimyasal reaksiyon mühendisliğine giriş, Kesikli ve akışlı reaktörlerin tasarım eşitliklerinin belirlenmesi, 2 Genel mol denkliği; Kesikli, sürekli
Çözünürlük kuralları
 Çözünürlük kuralları Bütün amonyum, bileşikleri suda çok çözünürler. Alkali metal (Grup IA) bileşikleri suda çok çözünürler. Klorür (Cl ), bromür (Br ) ve iyodür (I ) bileşikleri suda çok çözünürler, ancak
Çözünürlük kuralları Bütün amonyum, bileşikleri suda çok çözünürler. Alkali metal (Grup IA) bileşikleri suda çok çözünürler. Klorür (Cl ), bromür (Br ) ve iyodür (I ) bileşikleri suda çok çözünürler, ancak
KİMYA II DERS NOTLARI
 KİMYA II DERS NOLARI Yrd. Doç. Dr. Atilla EVCİN Kimyasal ermodinamik Çevremizde neler oluyor? Su neden buharlaşıyor? Sıcak nesneler neden soğuyor? Bazı moleküller diğerleriyle reaksiyona girerken, bazılarıyla
KİMYA II DERS NOLARI Yrd. Doç. Dr. Atilla EVCİN Kimyasal ermodinamik Çevremizde neler oluyor? Su neden buharlaşıyor? Sıcak nesneler neden soğuyor? Bazı moleküller diğerleriyle reaksiyona girerken, bazılarıyla
GENEL KİMYA. 10. Hafta.
 GENEL KİMYA 10. Hafta. Gazlar 2 Gaz halindeki elementler 25 0 C ve 1 atmosfer de gaz halinde bulunan elementler 3 Gaz halindeki bileşikler 4 Gazların Genel Özellikleri Gazlar, bulundukları kabın şeklini
GENEL KİMYA 10. Hafta. Gazlar 2 Gaz halindeki elementler 25 0 C ve 1 atmosfer de gaz halinde bulunan elementler 3 Gaz halindeki bileşikler 4 Gazların Genel Özellikleri Gazlar, bulundukları kabın şeklini
EDUCATIONAL MATERIALS
 PROBLEM SET 1. (2.1) Mükemmel karıştırılmış, sabit hacimli tank, aynı sıvıyı içeren iki giriş akımına sahiptir. Her akımın sıcaklığı ve akış hızı zamanla değişebilir. a) Geçiş işlemini ifade eden dinamik
PROBLEM SET 1. (2.1) Mükemmel karıştırılmış, sabit hacimli tank, aynı sıvıyı içeren iki giriş akımına sahiptir. Her akımın sıcaklığı ve akış hızı zamanla değişebilir. a) Geçiş işlemini ifade eden dinamik
Kristalizasyon Kinetiği
 Kristalizasyon Kinetiği İçerik Amorf malzemeler amorf kristal Belirli bir kristal yapısı yoktur Atomlar rastgele dizilir Belirli bir kristal yapısı vardır Atomlar belirli bir düzende dizilir camlar amorf
Kristalizasyon Kinetiği İçerik Amorf malzemeler amorf kristal Belirli bir kristal yapısı yoktur Atomlar rastgele dizilir Belirli bir kristal yapısı vardır Atomlar belirli bir düzende dizilir camlar amorf
10. Sınıf Kimya Konuları KİMYANIN TEMEL KANUNLARI VE TEPKİME TÜRLERİ Kimyanın Temel Kanunları Kütlenin korunumu, sabit oranlar ve katlı oranlar
 10. Sınıf Kimya Konuları KİMYANIN TEMEL KANUNLARI VE TEPKİME TÜRLERİ Kimyanın Temel Kanunları Kütlenin korunumu, sabit oranlar ve katlı oranlar kanunları Demir (II) sülfür bileşiğinin elde edilmesi Kimyasal
10. Sınıf Kimya Konuları KİMYANIN TEMEL KANUNLARI VE TEPKİME TÜRLERİ Kimyanın Temel Kanunları Kütlenin korunumu, sabit oranlar ve katlı oranlar kanunları Demir (II) sülfür bileşiğinin elde edilmesi Kimyasal
KİMYA-IV. Yrd. Doç. Dr. Yakup Güneş
 KİMYA-IV Yrd. Doç. Dr. Yakup Güneş Organik Kimyaya Giriş Kimyasal bileşikler, eski zamanlarda, elde edildikleri kaynaklara bağlı olarak Anorganik ve Organik olmak üzere, iki sınıf altında toplanmışlardır.
KİMYA-IV Yrd. Doç. Dr. Yakup Güneş Organik Kimyaya Giriş Kimyasal bileşikler, eski zamanlarda, elde edildikleri kaynaklara bağlı olarak Anorganik ve Organik olmak üzere, iki sınıf altında toplanmışlardır.
Sıvılar ve Katılar. Maddenin Halleri. Sıvıların Özellikleri. MÜHENDİSLİK KİMYASI DERS NOTLARI Yrd. Doç. Dr. Atilla EVCİN
 Sıvılar ve Katılar MÜHENDİSLİK KİMYASI DERS NOTLARI Yrd. Doç. Dr. Atilla EVCİN Sıcaklık düşürülürse gaz moleküllerinin kinetik enerjileri azalır. Bu nedenle, bir gaz yeteri kadar soğutulursa moleküllerarası
Sıvılar ve Katılar MÜHENDİSLİK KİMYASI DERS NOTLARI Yrd. Doç. Dr. Atilla EVCİN Sıcaklık düşürülürse gaz moleküllerinin kinetik enerjileri azalır. Bu nedenle, bir gaz yeteri kadar soğutulursa moleküllerarası
TERMODİNAMİĞİN BİRİNCİ YASASI
 İzotermal ve Adyabatik İşlemler Sıcaklığı sabit tutulan sistemlerde yapılan işlemlere izotermal işlem, ısı alışverişlerine göre yalıtılmış sistemlerde yapılan işlemlere ise adyabatik işlem adı verilir.
İzotermal ve Adyabatik İşlemler Sıcaklığı sabit tutulan sistemlerde yapılan işlemlere izotermal işlem, ısı alışverişlerine göre yalıtılmış sistemlerde yapılan işlemlere ise adyabatik işlem adı verilir.
BORUSAL (TUBULAR) AKIŞ REAKTÖRÜ
 BORUSAL (TUBULAR) AKIŞ REAKTÖRÜ Bursa Teknik Üniversitesi DBMMF Kimya Mühendisliği Bölümü 1 1. Amaç Borusal akış reaktörde, sabunlaşma reaksiyonunun kalma zamanına bağlı olarak dönüşümünü ve bu dönüşüm
BORUSAL (TUBULAR) AKIŞ REAKTÖRÜ Bursa Teknik Üniversitesi DBMMF Kimya Mühendisliği Bölümü 1 1. Amaç Borusal akış reaktörde, sabunlaşma reaksiyonunun kalma zamanına bağlı olarak dönüşümünü ve bu dönüşüm
NOT: Toplam 5 soru çözünüz, sınav süresi 90 dakikadır. SORULAR VE ÇÖZÜMLER
 Adı- Soyadı: Fakülte No : Gıda Mühendisliği Bölümü, 2016/2017 Öğretim Yılı, Güz Yarıyılı 00391-Termodinamik Dersi, Dönem Sonu Sınavı Soru ve Çözümleri 13.01.2017 Soru (puan) 1 (20) 2 (20) 3 (20) 4 (20)
Adı- Soyadı: Fakülte No : Gıda Mühendisliği Bölümü, 2016/2017 Öğretim Yılı, Güz Yarıyılı 00391-Termodinamik Dersi, Dönem Sonu Sınavı Soru ve Çözümleri 13.01.2017 Soru (puan) 1 (20) 2 (20) 3 (20) 4 (20)
Genel Kimya 101-Lab (4.Hafta) Asit Baz Teorisi Suyun İyonlaşması ve ph Asit Baz İndikatörleri Asit Baz Titrasyonu Deneysel Kısım
 Genel Kimya 101-Lab (4.Hafta) Asit Baz Teorisi Suyun İyonlaşması ve ph Asit Baz İndikatörleri Asit Baz Titrasyonu Deneysel Kısım Asit Baz Teorisi Arrhenius Teorisi: Sulu çözeltlerine OH - iyonu bırakan
Genel Kimya 101-Lab (4.Hafta) Asit Baz Teorisi Suyun İyonlaşması ve ph Asit Baz İndikatörleri Asit Baz Titrasyonu Deneysel Kısım Asit Baz Teorisi Arrhenius Teorisi: Sulu çözeltlerine OH - iyonu bırakan
Entropi tünelinden çıkmanın tek yolu ekserji iksirini içmektir! (A. Midilli)
 Entropi tünelinden çıkmanın tek yolu ekserji iksirini içmektir! (A. Midilli) Kişilik, enerjiyi yönetebilme ve verimli kullanabilme kabiliyetinin bir göstergesidir (A. Midilli) SUMMER COURSE ON EXERGY AND
Entropi tünelinden çıkmanın tek yolu ekserji iksirini içmektir! (A. Midilli) Kişilik, enerjiyi yönetebilme ve verimli kullanabilme kabiliyetinin bir göstergesidir (A. Midilli) SUMMER COURSE ON EXERGY AND
NOT: Toplam 5 soru çözünüz, sınav süresi 90 dakikadır. SORULAR VE ÇÖZÜMLER
 Adı- Soyadı: Fakülte No : Gıda Mühendisliği Bölümü, 2015/2016 Öğretim Yılı, Güz Yarıyılı 00391-Termodinamik Dersi, Dönem Sonu Sınavı Soru ve Çözümleri 07.01.2016 Soru (puan) 1 (20) 2 (20) 3 (20) 4 (20)
Adı- Soyadı: Fakülte No : Gıda Mühendisliği Bölümü, 2015/2016 Öğretim Yılı, Güz Yarıyılı 00391-Termodinamik Dersi, Dönem Sonu Sınavı Soru ve Çözümleri 07.01.2016 Soru (puan) 1 (20) 2 (20) 3 (20) 4 (20)
ASİT-BAZ DENGESİ ÖSS DE ÇIKMIŞ SORULAR
 1. Amonyağın, NH 3, baz özelliği gösterdiğini açıklayan denklem aşağıdakilerden hangisidir? A) NH 3(gaz) NH 3(sıvı) B) N 2(gaz) + 3H 2(gaz) 2NH 3(gaz) C) 2NH 3(gaz) +5/2O 2(gaz) 2NO (gaz) + 3H 2 O (gaz)
1. Amonyağın, NH 3, baz özelliği gösterdiğini açıklayan denklem aşağıdakilerden hangisidir? A) NH 3(gaz) NH 3(sıvı) B) N 2(gaz) + 3H 2(gaz) 2NH 3(gaz) C) 2NH 3(gaz) +5/2O 2(gaz) 2NO (gaz) + 3H 2 O (gaz)
ATOM HAREKETLERİ ve ATOMSAL YAYINIM
 ATOM HAREKETLERİ ve ATOMSAL YAYINIM 1. Giriş Malzemelerde üretim ve uygulama sırasında görülen katılaşma, çökelme, yeniden kristalleşme, tane büyümesi gibi olaylar ile kaynak, lehim, sementasyon gibi işlemler
ATOM HAREKETLERİ ve ATOMSAL YAYINIM 1. Giriş Malzemelerde üretim ve uygulama sırasında görülen katılaşma, çökelme, yeniden kristalleşme, tane büyümesi gibi olaylar ile kaynak, lehim, sementasyon gibi işlemler
ELLINGHAM DİYAGRAMLARI
 7 ELLINGHAM DİYAGRAMLARI 7.1. Giriş Ellingham, 1944 yılında oksitli bileşenlerin sıcaklığa karşı oluşum standart serbest enerji değişimlerini gösteren grafiği çizen ilk kişidir. Daha sonraları aynı diyagram
7 ELLINGHAM DİYAGRAMLARI 7.1. Giriş Ellingham, 1944 yılında oksitli bileşenlerin sıcaklığa karşı oluşum standart serbest enerji değişimlerini gösteren grafiği çizen ilk kişidir. Daha sonraları aynı diyagram
ÜÇ BİLEŞENLİ REAKSİYON SİSTEMLERİ İÇEREN REAKTİF DİSTİLASYON KOLONU VE REAKTÖR/DİSTİLASYON KOLONU PROSESLERİNİN NİCELİKSEL KARŞILAŞTIRMASI
 ÜÇ BİLEŞENLİ REAKSİYON SİSTEMLERİ İÇEREN REAKTİF DİSTİLASYON KOLONU VE REAKTÖR/DİSTİLASYON KOLONU PROSESLERİNİN NİCELİKSEL KARŞILAŞTIRMASI Denizhan YILMAZ, Saliha YILMAZ, Eda HOŞGÖR, Devrim B. KAYMAK *
ÜÇ BİLEŞENLİ REAKSİYON SİSTEMLERİ İÇEREN REAKTİF DİSTİLASYON KOLONU VE REAKTÖR/DİSTİLASYON KOLONU PROSESLERİNİN NİCELİKSEL KARŞILAŞTIRMASI Denizhan YILMAZ, Saliha YILMAZ, Eda HOŞGÖR, Devrim B. KAYMAK *
POLİMER KİMYASI -9. Prof. Dr. Saadet K. Pabuccuoğlu
 POLİMER KİMYASI -9 Prof. Dr. Saadet K. Pabuccuoğlu Genellikle merkaptanların Ci değeri büyük olduğundan bir çok polimerizasyon sisteminde molekül ağırlığı kontrolü için çok az miktarlarda kullanılır. ZİNCİR
POLİMER KİMYASI -9 Prof. Dr. Saadet K. Pabuccuoğlu Genellikle merkaptanların Ci değeri büyük olduğundan bir çok polimerizasyon sisteminde molekül ağırlığı kontrolü için çok az miktarlarda kullanılır. ZİNCİR
Redoks Kimyasını Gözden Geçirme
 Redoks Kimyasını Gözden Geçirme I. Yükseltgenme Durumu ya da Sayısı Bir bileşiğin yükseltgenme durumu ya da sayısı, ne derece yükseltgenmiş (elektronca fakir) ya da indirgenmiş (elektronca zengin) bir
Redoks Kimyasını Gözden Geçirme I. Yükseltgenme Durumu ya da Sayısı Bir bileşiğin yükseltgenme durumu ya da sayısı, ne derece yükseltgenmiş (elektronca fakir) ya da indirgenmiş (elektronca zengin) bir
Bölüm 4 KAPALI SİSTEMLERİN ENERJİ ANALİZİ
 Bölüm 4 KAPALI SİSTEMLERİN ENERJİ ANALİZİ http://public.cumhuriyet.edu.tr/alipinarbasi/ 1 Prof. Dr. Ali PINARBAŞI Amaçlar Özellikle otomobil motoru ve kompresör gibi pistonlu makinelerde yaygın olarak
Bölüm 4 KAPALI SİSTEMLERİN ENERJİ ANALİZİ http://public.cumhuriyet.edu.tr/alipinarbasi/ 1 Prof. Dr. Ali PINARBAŞI Amaçlar Özellikle otomobil motoru ve kompresör gibi pistonlu makinelerde yaygın olarak
TAMPON ÇÖZELTİLER. Prof.Dr.Mustafa DEMİR M.DEMİR 09-TAMPON ÇÖZELTİLER 1
 TAMPON ÇÖZELTİLER Prof.Dr.Mustafa DEMİR M.DEMİR 09-TAMPON ÇÖZELTİLER 1 Tampon çözeltiler Kimyada belli ph larda çözelti hazırlamak ve bunu uzun süre kullanmak çok önemlidir. Ancak bu çözeltilerin saklanması
TAMPON ÇÖZELTİLER Prof.Dr.Mustafa DEMİR M.DEMİR 09-TAMPON ÇÖZELTİLER 1 Tampon çözeltiler Kimyada belli ph larda çözelti hazırlamak ve bunu uzun süre kullanmak çok önemlidir. Ancak bu çözeltilerin saklanması
4. Oksijen bileşiklerinde 2, 1, 1/2 veya +2 değerliklerini (N Metil: CH 3. Cevap C. Adı. 6. X bileşiği C x. Cevap E. n O2. C x.
 ÇÖZÜMLER. E foton h υ 6.0 34. 0 7 6.0 7 Joule Elektronun enerjisi E.0 8 n. (Z).0 8 (). () 8.0 8 Joule 0,8.0 7 Joule 4. ksijen bileşiklerinde,, / veya + değerliklerini alabilir. Klorat iyonu Cl 3 dir. (N
ÇÖZÜMLER. E foton h υ 6.0 34. 0 7 6.0 7 Joule Elektronun enerjisi E.0 8 n. (Z).0 8 (). () 8.0 8 Joule 0,8.0 7 Joule 4. ksijen bileşiklerinde,, / veya + değerliklerini alabilir. Klorat iyonu Cl 3 dir. (N
ENERJİ DENKLİKLERİ 1
 ENERJİ DENKLİKLERİ 1 Enerji ilk kez Newton tarafından ortaya konmuştur. Newton, kinetik ve potansiyel enerjileri tanımlamıştır. 2 Enerji; Potansiyel, Kinetik, Kimyasal, Mekaniki, Elektrik enerjisi gibi
ENERJİ DENKLİKLERİ 1 Enerji ilk kez Newton tarafından ortaya konmuştur. Newton, kinetik ve potansiyel enerjileri tanımlamıştır. 2 Enerji; Potansiyel, Kinetik, Kimyasal, Mekaniki, Elektrik enerjisi gibi
hesaplama (Ders #16 dan devam) II. İstemli değişim ve serbest enerji III. Entropi IV. Oluşum serbest enerjisi
 5.111 Ders Özeti #17 Bugün için okuma: Bölüm 7.1 İstemli değişme, Bölümler 7.2 ve 7.8 -Entropi, Bölümler 7.12, 7.13, ve 7.15 Serbest Enerji. Ders #18 için okuma: Bölüm 7.16 Biyolojik Sistemlerde Serbest-Enerji
5.111 Ders Özeti #17 Bugün için okuma: Bölüm 7.1 İstemli değişme, Bölümler 7.2 ve 7.8 -Entropi, Bölümler 7.12, 7.13, ve 7.15 Serbest Enerji. Ders #18 için okuma: Bölüm 7.16 Biyolojik Sistemlerde Serbest-Enerji
DENEY FÖYÜ BALIKESİR-2015
 DENEY FÖYÜ BALIKESİR-2015 2 İçindekiler DEVRE ŞEMASI... 3 DENEY SETİNDE KULLANILAN MALZEMELER... 3 TEORİK BİLGİ... 4 BOYLE-MARİOTTE KANUNU... 4 GAY-LUSSAC KANUNU... 7 DENEYLER... 10 Deney TE 680-01...
DENEY FÖYÜ BALIKESİR-2015 2 İçindekiler DEVRE ŞEMASI... 3 DENEY SETİNDE KULLANILAN MALZEMELER... 3 TEORİK BİLGİ... 4 BOYLE-MARİOTTE KANUNU... 4 GAY-LUSSAC KANUNU... 7 DENEYLER... 10 Deney TE 680-01...
Yrd. Doç. Dr. Atilla EVCİN Afyonkarahisar Yrd. Doç. Dr. Atilla EVCİN Afyonkarahisar Temel: 100 mol kuru su gazı. caklık k ve 5 bar basınc
 Yrd. Doç. Dr. Atilla EVCİN Afyonkarahisar 007 ÖRNEK 5-165 00 0 C sıcakls caklık k ve 5 bar basınc ncında nda olan bir kızgk zgın n buhar, 100 0 C sıcakls caklıkta kta olan kızgk zgın n kok kömürük üzerinden
Yrd. Doç. Dr. Atilla EVCİN Afyonkarahisar 007 ÖRNEK 5-165 00 0 C sıcakls caklık k ve 5 bar basınc ncında nda olan bir kızgk zgın n buhar, 100 0 C sıcakls caklıkta kta olan kızgk zgın n kok kömürük üzerinden
SULU ÇÖZELTİLERDE DENGE
 İMYASAL DENGE SULU ÇÖZELTİLERDE DENGE Prof. Dr. Mustafa DEMİR M.DEMİR 06-İMYASAL DENGE 1 SULU ÇÖZELTİLERDE DENGE Bileşikler suda, özelliklerine göre az veya çok oranda ayrışarak iyonlaşırlar. İyon içeren
İMYASAL DENGE SULU ÇÖZELTİLERDE DENGE Prof. Dr. Mustafa DEMİR M.DEMİR 06-İMYASAL DENGE 1 SULU ÇÖZELTİLERDE DENGE Bileşikler suda, özelliklerine göre az veya çok oranda ayrışarak iyonlaşırlar. İyon içeren
KİMYA II DERS NOTLARI
 Yrd. Doç. Dr. Atilla EVCİN Afyonkarahisar Kocatepe Üniversitesi 007 KİYA II DERS NOTLARI Yrd. Doç. Dr. Atilla EVCİN Asit Baz Tanımları Asit ve baz, değişik zamanlarda değişik şekillerde tanımlanmıştır.
Yrd. Doç. Dr. Atilla EVCİN Afyonkarahisar Kocatepe Üniversitesi 007 KİYA II DERS NOTLARI Yrd. Doç. Dr. Atilla EVCİN Asit Baz Tanımları Asit ve baz, değişik zamanlarda değişik şekillerde tanımlanmıştır.
T.C. SELÇUK ÜNİVERSİTESİ MÜHENDİSLİK MİMARLIK FAKÜLTESİ KİMYA MÜHENDİSLİĞİ BÖLÜMÜ KİMYA MÜHENDİSLİĞİ LABORATUARI BORUSAL REAKTÖR DENEYİ 2017 KONYA
 T.C. SELÇUK ÜNİVERSİTESİ MÜHENDİSLİK MİMARLIK FAKÜLTESİ KİMYA MÜHENDİSLİĞİ BÖLÜMÜ KİMYA MÜHENDİSLİĞİ LABORATUARI BORUSAL REAKTÖR DENEYİ 2017 KONYA İÇİNDEKİLER 1. SİMGELER... 3 2. GİRİŞ... 3 3. DENEY DÜZENEĞİ...
T.C. SELÇUK ÜNİVERSİTESİ MÜHENDİSLİK MİMARLIK FAKÜLTESİ KİMYA MÜHENDİSLİĞİ BÖLÜMÜ KİMYA MÜHENDİSLİĞİ LABORATUARI BORUSAL REAKTÖR DENEYİ 2017 KONYA İÇİNDEKİLER 1. SİMGELER... 3 2. GİRİŞ... 3 3. DENEY DÜZENEĞİ...
Termodinamik. Öğretim Görevlisi Prof. Dr. Lütfullah Kuddusi. Bölüm 4: Kapalı Sistemlerin Enerji Analizi
 Termodinamik Öğretim Görevlisi Prof. Dr. Lütfullah Kuddusi 1 Bölüm 4 KAPALI SİSTEMLERİN ENERJİ ANALİZİ 2 Amaçlar Özellikle otomobil motoru ve kompresör gibi pistonlu makinelerde yaygın olarak karşılaşılan
Termodinamik Öğretim Görevlisi Prof. Dr. Lütfullah Kuddusi 1 Bölüm 4 KAPALI SİSTEMLERİN ENERJİ ANALİZİ 2 Amaçlar Özellikle otomobil motoru ve kompresör gibi pistonlu makinelerde yaygın olarak karşılaşılan
Hüsniye DURMAZ Murat SARAÇOĞLU Hikmet SAYILKAN Gamze DOLU Mehmet TUNÇEL. 5. Baskı
 Editör: Hüseyin BAĞ Kemal DOYMUŞ Hüsniye DURMAZ Murat SARAÇOĞLU Hikmet SAYILKAN Gamze DOLU Mehmet TUNÇEL 5. Baskı Editör: Prof. Dr. Hüseyin Bağ GENEL KİMYA-2 ISBN 978-605-318-420-1 Kitapta yer alan bölümlerin
Editör: Hüseyin BAĞ Kemal DOYMUŞ Hüsniye DURMAZ Murat SARAÇOĞLU Hikmet SAYILKAN Gamze DOLU Mehmet TUNÇEL 5. Baskı Editör: Prof. Dr. Hüseyin Bağ GENEL KİMYA-2 ISBN 978-605-318-420-1 Kitapta yer alan bölümlerin
ÖĞRETĐM TEKNOLOJĐLERĐ VE MATERYAL GELĐŞTĐRME DERSĐ GAZLAR KONU ANLATIMI
 2008 ANKARA ÖĞRETĐM TEKNOLOJĐLERĐ VE MATERYAL GELĐŞTĐRME DERSĐ GAZLAR KONU ANLATIMI DERS SORUMLUSU:Prof. Dr. Đnci MORGĐL HAZIRLAYAN:Derya ÇAKICI 20338451 GAZLAR Maddeler tabiatta katı, sıvı ve gaz olmak
2008 ANKARA ÖĞRETĐM TEKNOLOJĐLERĐ VE MATERYAL GELĐŞTĐRME DERSĐ GAZLAR KONU ANLATIMI DERS SORUMLUSU:Prof. Dr. Đnci MORGĐL HAZIRLAYAN:Derya ÇAKICI 20338451 GAZLAR Maddeler tabiatta katı, sıvı ve gaz olmak
